Ignoti nutta curatio morbiu.
Нельзя лечить нераспознанную болезнь.
Bene diagnoscitur, bene curatur.
Хорошо распознается, хорошо лечится.
У многих лиц с язвенным колитом (ЯК) и болезнью Крона (БК) с момента появления первых клинических симптомов до постановки диагноза проходит довольно длительный период. В это время наблюдаются многочисленные жалобы и клинические симптомы, которые, несмотря на проводимые обследования, не находят объяснения. По данным различных исследователей, у лиц с БК с момента первого посещения врача до постановки диагноза проходит в среднем 8,3 мес., а при ЯК — 4,5 мес. У 15 % пациентов с БК первоначально ставится диагноз ЯК, еще у 15 % — острого или хронического аппендицита, у 3 % — гинекологического заболевания, опухоли брюшной полости или ревматического заболевания. И только знание многообразной клинической картины хронических воспалительных заболеваний кишечника (ХВЗК) позволяет сократить время до правильной постановки диагноза, своевременно назначить адекватное лечение, улучшить качество жизни пациента.
Клиническая картина воспалительных заболеваний кишечника может характеризоваться не только диареей, но и внекишечными проявлениями, которые иногда бывают выражены в большей степени, чем кишечные симптомы. Поражение различных органов и систем у больных ЯК и БК может быть отражением внекишечных проявлений, осложнений и последствий основного заболевания, результатом побочного действия лекарственных препаратов или же проявлением случайно сочетающихся заболеваний.
Этиология и патогенез данных симптомов, а также их взаимосвязь с хроническими воспалительными заболеваниями кишечника часто остаются недостаточно ясными.
H.J. Hodgson (1992) предложил следующую классификацию внекишечных проявлений ВЗК:
1. Связанные с острым воспалением в кишечнике:
— поражения кожи и слизистой полости рта;
— периферические артриты;
— поражения глаз.
2. Ассоциированные состояния:
— анкилозирующий спондилит и сакроилеит;
— болезни печени;
— пульмонологические, кардиологические, сосудистые и гематологические проблемы.
3. Последствия мальабсорбции (резекция или хроническое воспаление):
— дефицитные состояния;
— амилоидоз;
— мочекаменная болезнь;
— эндокринные нарушения.
4. Медикаментозно-индуцированные состояния.
Реактивные состояния, являющиеся ответом различных органов и систем на воспаление в кишечнике, как правило, манифестируют клинически в соответ-ствии со степенью активности основного заболевания. Ассоциированные состояния не являются немедленной реакцией на воспаление в кишечнике. Эти состояния скорее могут предшествовать болезни кишечника или протекать независимо.
К внекишечным проявлениям, которые патофизиологически обусловлены длительно текущим воспалительным заболеванием кишечника, связаны с нарушением функции тонкой и толстой кишок, резекцией участка кишки, относятся метаболические расстройства, синдром мальабсорбции, амилоидоз. Хроническая интоксикация, окислительный стресс на фоне истощения антиоксидантной защиты, водно-электролитный дисбаланс с метаболическими нарушениями являются основой развития дистрофических процессов в различных органах. То есть создаются благоприятные условия для возникновения таких состояний, как миокардио-дистрофия, остеопороз, образование камней в желчном пузыре и почках.
Нарушение цитокиновой регуляции, приводящее к активации иммунокомпетентных клеток и стимуляции апоптоза, повышенный синтез антител, в том числе перекрестно реагирующих, избыточное образование циркулирующих иммунных комплексов (ЦИК), нарушение слизистого барьера кишечника с повышенной выработкой биологически активных аминов — серотонина и гистамина и нарушением микроциркуляции могут не только быть основой для поддержания воспаления в кишечнике, но и вызывать формирование внекишечных проявлений.
Внекишечные проявления и поражения других органов и систем, встречающиеся при ВЗК, можно систематизировать следующим образом (C. Su, G. Lichtensteine, 2006) (табл. 1).
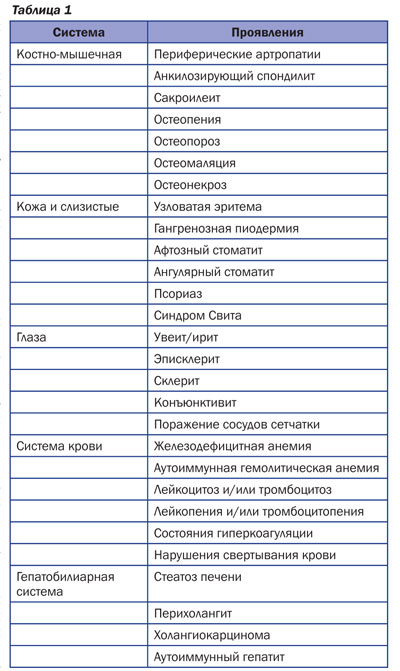
Частота внекишечных проявлений, по данным различных исследователей, колеблется в очень широких пределах. Иногда в эту группу относят даже отдель-ные самостоятельные заболевания, которые у больных неспецифическим язвенным колитом (НЯК) и БК встречаются чаще, чем в общей популяции. Например, псориаз, анкилозирующий спондилит, первичный билиарный цирроз (ПБЦ) печени. Причины, приводящие к учащению этих состояний, в каждом случае свои, но рассматривать подобные явления, вероятно, целесообразно как ассоциацию ВЗК с другими заболеваниями с общими патогенетическими звеньями. Так, для анкилозирующего спондилита и язвенного колита характерны единые дефекты Т-клеточного звена иммунитета; для ПБЦ и ВЗК — сходные нарушения цитокиновой регуляции со стимуляцией фиброгенеза.
При поражении разных органов и систем удельный вес отдельных патогенетических механизмов отличается, поэтому у больных с различной распространенностью, активностью, степенью тяжести основного заболевания внекишечные проявления встречаются с разной частотой.
Наиболее часто встречаются поражения кожи, суставов, слизистой полости рта, глаз, печени и желчевыводящих путей. В случаях вовлечения в патологический процесс толстой кишки различные реактивные состояния отмечены почти в 2 раза чаще, чем при изолированном терминальном илеите.
Среди поражений кожи при ВЗК можно выделить специфические изменения, кожные проявления, являющиеся результатом синдрома мальабсорбции или проводимого лечения, и различные ассоциированные состояния.
 Наиболее частым кожным проявлением при ВЗК является узловатая эритема (УЭ) (рис. 1).
Наиболее частым кожным проявлением при ВЗК является узловатая эритема (УЭ) (рис. 1).
Она представляет собой горячий на ощупь, слегка возвышающийся пораженный участок кожи красного цвета, локализующийся преимущественно на претибиальной поверхности голени. Частота УЭ у больных ВЗК составляет 2–4 %, наблюдается в основном у женщин. При гистологическом исследовании обнаруживается острая воспалительная реакция соединительной ткани с отеком, лейкоцитарной и лимфогистиоцитарной инфильтрацией (панникулит). УЭ представляет собой неспецифический аллергический ответ организма на различные инфекции (стрептококки, туберкулез, грибковые и вирусные инфекции) и гранулематозные заболевания. Появление УЭ соответ-ствует в большинстве случаев отчетливой активности ВЗК, но может наблюдаться и незадолго до возникновения его обострения. На фоне лечения основного заболевания УЭ исчезает, оставляя иногда после себя участки гиперпигментации.
Гангренозная пиодермия встречается у 1–2 % пациентов с ВЗК. Гангренозную пиодермию можно обнаружить как в фазу обострения основного заболевания, так и в фазу ремиссии (рис. 2).
В ряде случаев возникновению кожных изменений предшествует появление боли в соответствующем участке кожи. Часто поражение начинается с образования гнойной пустулы, которая, проходя последовательно стадии гематомы и стерильного абсцесса, переходит в язву до 4 см. Дно гнойной некротизирующей язвы обычно бывает окружено неравномерным красным ободком. Поражения при гангренозной пиодермии локализуются преимущественно на разгибательной поверхности нижних конечностей, но могут располагаться и на других участках кожи. В тех случаях, когда при гангренозной пиодермии развиваются множественные поражения, они возникают либо одновременно, либо друг за другом. Примерно у 1/3 пациентов наблюдаются рецидивы.
Патогенез гангренозной пиодермии остается недостаточно ясным. В ряде случаев речь может идти о метастатическом образовании абсцессов при бактериемии или о гранулематозном ангиите при БК, протекающем в условиях гиперчувствительности.
Наиболее эффективной является терапия, сочетающая местное воздействие на рану с системными кортикостероидами или циклоспорином А в дозе 3–10 мг/кг в сутки. Применяя любые методы лечения, необходимо помнить, что процесс заживления гангренозной пиодермии протекает медленно и может продолжаться до 1 года.
Поражения полости рта и кожи лица наблюдаются при болезни Крона в 6–30 % случаев (рис. 3).
Они проявляются отеком и язвами губ, эритематозными бляшками, язвами и афтами на слизистой оболочке десен и щек. Способствуют возникновению афт в полости рта дефицит железа, фолиевой кислоты, витамина В12, недостаточная выработка IgA. Кроме того, у больных могут отмечаться линейные язвы и трещины с плотными краями, локализующиеся как в области губ, так и на слизистой полости рта. Почти у 60 % больных поражения полости рта предшествуют появлению кишечных симптомов, а у трети пациентов они оказываются первым проявлением болезни Крона. При гистологическом исследовании биоптатов, взятых из пораженных участков слизистой оболочки полости рта, очень часто обнаруживаются гранулемы.
Синдром Свита представляет собой острый нейтрофильный дерматоз, протекающий с образованием болезненных эритематозных бляшек или узелков, которые локализуются на различных участ-ках тела и появление которых часто сопровождается лихорадкой и лейкоцитозом в периферической крови. Синдром Свита относят к редким кожным проявлениям болезни Крона, и в ряде случаев он сочетается с узловатой эритемой, конъюнктивитом и артралгиями. При гистологическом исследовании пораженных участков обнаруживается выраженная периваскулярная инфильтрация полиморфноядерными гранулоцитами без признаков васкулита. Эта кожная форма болезни Крона чаще встречается у женщин.
 Узелковый панартериит кожи описан только в сочетании с болезнью Крона. Клинически он проявляется многочисленными мягкими красноватыми подкожными болезненными узелками размером до 2 см, которые иногда склонны к изъязвлению. Они могут возникать как на нормальной коже, так и на участках сетчатой «мраморной» кожи и располагаются обычно билатерально и симметрично на нижних конечностях. Гистологически обнаруживается воспаление всех слоев стенки сосудов подкожной клетчатки. Воспалительный инфильтрат состоит из полиморфноядерных гранулоцитов, эозинофилов и круглых клеток и распространяется на периваскулярную соединительную ткань. Воспалительные и деструктивные изменения ведут к облитерации сосудов. В целом узелковый панартериит протекает достаточно благоприятно, и у половины больных отмечается его спонтанное регрессирование.
Узелковый панартериит кожи описан только в сочетании с болезнью Крона. Клинически он проявляется многочисленными мягкими красноватыми подкожными болезненными узелками размером до 2 см, которые иногда склонны к изъязвлению. Они могут возникать как на нормальной коже, так и на участках сетчатой «мраморной» кожи и располагаются обычно билатерально и симметрично на нижних конечностях. Гистологически обнаруживается воспаление всех слоев стенки сосудов подкожной клетчатки. Воспалительный инфильтрат состоит из полиморфноядерных гранулоцитов, эозинофилов и круглых клеток и распространяется на периваскулярную соединительную ткань. Воспалительные и деструктивные изменения ведут к облитерации сосудов. В целом узелковый панартериит протекает достаточно благоприятно, и у половины больных отмечается его спонтанное регрессирование.
Поражения суставов при ВЗК могут протекать в форме периферических артропатий (5–20 %), сакроилеита (4–18 %) и анкилозирующего спондилита (1–2 %). Выявлена генетическая предрасположенность к развитию анкилозирующего спондилита и связь заболевания с наличием антигена HLA B27. Хотя у лиц с БК и НЯК не выявлено повышенной частоты этого антигена, однако при сочетании ВЗК с антигеном HLA B27 риск возникновения анкилозирующего спондилита существенно возрастает.
Моно- и полиартриты относятся к наиболее частым внекишечным проявлениям воспалительных заболеваний кишечника. Характерно их сочетание с изменениями кожи. При выраженной воспалительной активности основного заболевания и при поражении толстой кишки артриты встречаются чаще. Однако иногда они могут наблюдаться и задолго до появления первых клинических симптомов воспаления в кишечнике, а также в фазу ремиссии. Чаще страдают коленные и голеностопные суставы. Далее следуют локтевые, тазобедренные, межфаланговые и плюсневые суставы. Артриты носят асимметричный характер, воспалительный процесс может переходить с одного сустава на другой и сочетаться с поражением сухожилий в местах их прикрепления к кости. В первую очередь эти воспалительные изменения возникают в ахилловом сухожилии и связке надколенника. У большинства больных артриты не приводят к деформации или деструкции суставов. При рентгенологическом исследовании не выявляется каких-либо грубых изменений, за исключением отека мягких тканей.
Различают два типа периферических артропатий при ВЗК. К І типу относят асимметричное поражение менее 5 крупных суставов (коленного, локтевого, голеностопного), возникающее остро, эпизодически, сочетающееся с активным воспалением в кишечнике. Выявлена генетическая ассоциация этого типа артропатии с HLA DR B1*0103 и В*35. Ко ІІ типу относят множественное, персистирующее, независимо от активности основного заболевания, поражение мелких суставов, которое ассоциировано с HLA B44.
Воспалительные явления в суставах, как правило, стихают на фоне терапии основного заболевания кортикостероидами или месалазином. Если стандартная терапия оказывается неэффективной, целесообразно применение противовоспалительных и нестероидных противовоспалительных средств.
Частота воспалительных заболеваний глаз у больных НЯК и БК составляет от 5 до 8 %. Они часто сочетаются с другими внекишечными проявлениями ВЗК. Чаще других встречаются эписклерит (рис. 4) и передний увеит (ирит, иридоциклит). Склерит и эписклерит характеризуются изменениями в виде гиперемии склер и конъюнктивы, а также инъекции склер, которые сопровождаются умеренным жжением и раздражением. Обычно существует корреляция между выраженностью эписклерита и активностью основного заболевания. При иридоциклите появляются боли в глазах, пелена перед глазами и головные боли. Следствием иридоциклита может быть образование спаек между радужной оболочкой и пе-редней поверхностью хрусталика с нарушением формы зрачка и расстройствами его функции. Лечение сводится к местному применению кортикостероидов.
Поражения печени и желчевыводящих путей при ВЗК неоднородны и имеют разные патогенетические механизмы формирования. Они варьируют от метаболических нарушений, таких как желчнокаменная болезнь и стеатогепатит, до аутоиммунных нарушений, вплоть до первичного склерозирующего холангита (ПСХ) и первичного билиарного цирроза печени. При этом нередко не удается провести четкую границу между поражением печени и желчных протоков как вариантом внекишечных проявлений при ХВЗК и изменениями гепатобилиарной системы как проявлением сопутствующих заболеваний.
ПСХ наблюдается примерно у 2–7 % больных ВЗК, причем заболевание чаще встречается при язвенном колите, чем при болезни Крона. Болеют преимущественно лица моложе 45 лет. При помощи эндоскопической ретроградной холецистохолангиографии ПСХ можно распознать на ранних стадиях. Характерны участки сужения внутри- и внепеченочных желчных протоков с их отчетливым престенотическим расширением. У большинства больных с ПСХ выявляется распространенное поражение толстой кишки. В отдельных случаях заболевание может диагностироваться до появления первых признаков язвенного колита. Клинические проявления ПСХ могут быть очень вариабельными. У многих больных вначале заболевание протекает бессимптомно и характеризуется только повышением уровня щелочной фосфатазы (ЩФ) и гамма-глутамилтрансферазы. К наиболее частым симптомам относят утомляемость, зуд кожи, желтуху, потерю массы тела, лихорадку и боль в животе. Примерно у 30 % больных обнаруживаются различные антитела — антинуклеарные, антимитохондриальные, антитела к гладкой мускулатуре. Почти у 80 % больных обнаруживаются антитела к гранулоцитам — pANCA.
Выделяют 4 стадии ПСХ. В 1-й стадии клинические симптомы отсутствуют, и диагноз ставится на основании данных эндоскопической ретроградной холангио-панкреатографии. Во 2-й стадии клинических проявлений по-прежнему нет, но обнаруживается повышение уровня ЩФ. В 3-й стадии больные жалуются на утомляемость и зуд, а при лабораторном исследовании выявляются признаки холестаза. В 4-й стадии наблюдаются признаки декомпенсированного цирроза печени с явлениями портальной гипертензии. Заболевание неуклонно прогрессирует даже при отсутствии в течение длительного времени клинических симптомов.
Существует несколько теорий для объяснения патогенеза ПСХ. Наибольшее признание получила концепция его аутоиммунной природы. В подтверждение этому приводится его нередкая связь с другими аутоиммунными заболеваниями — тиреоидитом, системной красной волчанкой, спру, а также обнаружение антител к пептиду, который перекрестно реагирует с эпителиальными клетками толстой кишки и желчных протоков. Преимущественно липополисахаридные компоненты бактерий проксимального отдела толстой кишки, поступающие через портальную вену в печень, стимулируют синтез провоспалительных цитокинов купферовскими клетками (ИЛ-1, ФНО-альфа). Стимулируется фиброгенез, который в условиях окислительного стресса выходит из-под контроля макрофагов.
Другой механизм развития ПБЦ и ПСХ — это аутоагрессия с выработкой антимитохондриальных антител. При этом образуются ЦИК, которые откладываются в желчных протоках. В ответ на это развивается реакция замедленного типа с нарушением клеточного звена иммунитета, инверсией регуляторных субпопуляций Т-лимфоцитов.
ПСХ и ПБЦ имеют во многом сходные механизмы формирования, а возможно, являются этапами одного заболевания.
Использование урсофалька в дозе 15 мг/кг массы тела в сутки приводит к улучшению клинического течения заболевания и лабораторных показателей.
В ряде работ установлена взаимосвязь между развитием острого и хронического панкреатита, а также внешнесекреторной недостаточности поджелудочной железы и наличием ХВЗК. По-видимому, у части пациентов панкреатит действительно оказывается внекишечным проявлением БК, в других же случаях он может быть результатом побочного действия лекарственных препаратов или следствием поражения двенадцатиперстной кишки, а учитывая, что при БК часто обнаруживается желчнокаменная болезнь, необходимо исключать и билиарный генез панкреатита.
Мочекаменная болезнь выявляется примерно у 10 % пациентов с хроническими воспалительными заболеваниями кишечника. При поражении терминального отдела подвздошной кишки, а также у пациентов, перенесших резекцию этого участка кишки, обнаруживаются кальциево-оксалатные камни. Причиной образования таких камней является повышенное всасывание оксалатов в кишечнике, сочетающееся с синдромом мальабсорбции. В норме оксалаты, поступающие с пищей, связываются в просвете кишки с кальцием и выделяются с калом в виде нерастворимого оксалата кальция. При стеаторее в толстую кишку поступает большое количество свободных жирных кислот, связывающих кальций. Поскольку концентрация ионов кальция в просвете кишечника уменьшается, увеличивается всасывание свободных оксалатов. Деоксихолевая и хенодеоксихолевая кислоты повышают пассивную диффузию оксалатов через слизистую оболочку толстой кишки. Таким больным наряду с ограничением пищи, богатой оксалатами (шпинат, ревень, шоколад, чай), необходимо проводить лечение синдрома потери желчных кислот и стеатореи. Рекомендуется прием холестирамина и кальция.
Поражения нервной системы при ХВЗК включают в себя автономные и периферические нейропатии, неврологические нарушения, связанные с дефицитом фолиевой кислоты и витаминов, цереброваскулярные осложнения, побочные эффекты применения лекарственных препаратов (в частности, метронидазола), а также септические осложнения.
Таким образом, c учетом всех возможных внекишечных проявлений, НЯК и болезнь Крона справедливо относят к мультисистемным заболеваниям со сложным, недостаточно изученным патогенезом.
При всем многообразии клинических форм и внекишечных проявлений НЯК и БК успех терапии зависит от правильной диагностики, понимания сложных патогенетических механизмов заболеваний. В связи с этим хочется напомнить высказывание основоположника русской внутренней медицины М.Я. Мудрова: «Не должно лечить болезнь только по ее имени, а должно лечить самого больного, его органы, его силы».
Список литературы / References
1. Адлер Г. Болезнь Крона и язвенный колит / Пер. с нем. А.А. Шептулина. — М.: ГЭОТАРД-МЕД, 2001. — 528 с.
2. Губергриц Н.Б. Сочетание первичного склерозирующего холангита и неспецифического язвенного колита у двух однояйцевых близнецов // Сучасна гастроентерол. — 2009. — № 4 (48). — С. 83-87.
3. Barthet M., Hastier P., Bernard J.P. et al. Chronic pancreatitis and inflammatory bowel disease: True or coincidental association? // Am. J. Gastroenterol. — 1999. — № 94. — P. 2141.
4. Friedman S., Marion J.F., Scherl E. et al. Intravenous cyclosporine in refractory pyoderma gangrenosum complicating inflammatory bowel disease // Inflamm. Bowel Dis. — 2001. — № 7. — P. 1.
5. Galun E., Flugelman M.Y., Rachmilewitz D. Pyoderma gangrenosum complicating ulcerative colitis: Successful treatment with methylprednisolone pulse therapy and dapsone // Am. J. Gastroenterol. — 1986. — № 81. — P. 988.
6. Lapidus A., Bangstad M., Astrom M., Muhrbeck O. The prevalence of gallstone disease in a defined cohort of patients with Crohn's disease // Am. J. Gastroenterol. — 1999. — № 94. — P. 1261.
7. Lebwohl M., Lebwohl O. Cutaneous manifestations of inflammatory bowel disease // Inflamm. Bowel Dis. — 1998. — № 4. — Р. 142.
8. Lee F.I., Bellary S.V., Francis C. Increased occurrence of psoriasis in patients with Crohn's disease and their relatives // Am. J. Gastroenterol. — 1990. — № 85. — Р. 962.
9. Lisciandrano D., Ranzi T., Carrassi A. et al. Prevalence of oral lesions in inflammatory bowel disease // Am. J. Gastroenterol. — 1996. — № 91. — Р. 7.
10. Lyons J.L., Rosenbaum J.T. Uveitis associated with inflammatory bowel disease compared with uveitis associated with spondyloarthropathy // Arch. Ophthalmol. — 1997. — № 115. — Р. 61.
11. Miehsler W., Reinisch W., Valic E. et al. Is inflammatory bowel disease an independent and disease-specific risk factor for thromboembolism? // Gut. — 2004. — № 53. — Р. 542.
12. Orchard T.R., Thiyagaraja S., Welsh K.I. et al. Clinical phenotype is related to HLA genotype in the peripheral arthropathies of inflammatory bowel disease // Gastroenterology. — 2000. — № 118. — Р. 274.
13. Orchard T.R., Wordsworth B.P., Jewell D.P. Peripheral arthropathies in inflammatory bowel disease: Their articular distribution and natural history // Gut. — 1998. — № 42. — Р. 387.
14. Paradovska A.M., Kawala B., Braksator M. et al. Different character of oral mucosa changes in IBD // GCC. — 2009. — V. 3 (1). Abstracts of the 4th Congress of ECCO. — Hamburg, Germany. — Feb. 5–7, 2009. — S25.
15. Powell R.J., Holbrook M.R., Stevens A. Pyoderma gangrenosum and its treatment // Lancet. — 1997. — № 350. — Р. 1720.
16. Rasmussen H.H., Fallingborg J.F., Mortensen P.B. et al. Hepatobiliary dysfunction and primary sclerosing cholangitis in patients with Crohn's disease // Scand. J. Gastroenterol. — 1997. — № 32. — Р. 604.
17. Sartor R.B., Sandborn W.I. Kirsner's inflammatory bowel diseases. — 6th ed. — London: Saunders, 2004. — 754 p.
18. Schapira M., Henrion J., Ravoet C. et al. Thromboembolism in inflammatory bowel disease // Acta Gastroenterol. Belg. — 1999. — № 62. — Р. 182.
19. Sleisenger & Fordtran's gastrointestinal and liver diseases: pathophysiology, diagnosis, management / Ed. by M. Feldman, L.J. Brandt. — 8th ed. — 2006. — 2890 p.
20. Solem C.A., Loftus E.V., Tremaine W.J. et al Venous thromboembolism in inflammatory bowel disease // Am. J. Gastroenterol. — 2004. — № 99. — Р. 97.
21. Su C., Judge T.A., Lichtenstein G.R. Extraintestinal manifestations of inflammatory bowel disease // Gastroenterol. Clin. North. Am. — 2002. — № 31. — P. 307.
22. Travis S., Innes N., Davies M.G. et al. Sweet's syndrome: An unusual cutaneous feature of Crohn's disease or ulcerative colitis. The South West Gastroenterology Group // Eur. J. Gastroenterol. Hepatol. — 1997. — № 9. — Р. 715.
23. Veloso F.T., Carvalho J., Magro F. Immune-related systemic manifestations of inflammatory bowel disease: A prospective study of 792 patients // J. Clin. Gastroenterol. — 1996. — № 23. — P. 29.
24. Weismuller T.S., Wedemeyer J., Kubicka S. The challenges in primary sclerosing cholangitis — аetiopathogenesis, autoimmunity, management and malignancy // Hepatology. — 2008. — Vol. 48 (suppl. 1). — P. 38-57.









